 7
7
我公司专业办理欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂辅导,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、医疗器械单一体系审核MDSAP认证、BSCI验厂辅导、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证
何时需要510(k)
在下列情况下需要递交510(k):
次进行商业分配(上市)。在1976年5月28日之后(FD&C Act进行医疗器械修正的有效日期),任何想在美国出售医疗器械的人都要求在器械上市之前至少90天递交510(k)申请。如果器械在1976年5月28日之前不是由你的公司上市的,要求递交510(k)。
对于已上市器械提出不同的使用目的。510(k)规范(21 CFR 807)对于使用目的的主要变化,特别要求递交上市前通知书。使用目的在器械的标注或广告的声明中指出。然而,如果使用意图没有全部发生变化,大多数的变化都需要递交510(k)。
已上市器械发生改变或改进,如果这个改变能够严重影响器械的安全性或有效性的情况下。
申请人负责决定改进是否能够严重影响器械的安全性或有效性。无论得出怎样的结论,都要做纪录,此记录能够在器械主记录中反应出来,在医疗器械质量管理规范的要求下,改变控制记录。如果被询问到,申请者就能够证明评估了这个改动。
对现有器械进行了显著影响器械安全性或有效性的改变或改动,或者上市器械的指南为全新的,或与原来不同的情况下,要求递交新的,完整的510(k)文件。
我公司专业办理欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂辅导,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、医疗器械单一体系审核MDSAP认证、BSCI验厂辅导、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证
何时*510(k)
下面情况下* 510(k):
如果器械厂家向另一个企业卖没有完工的器械,要求进一步加工,其中包括用于其它企业组装器械的零件的情况下,不需要递交510(k)。 然而,如果生产的零件是要直接卖给终端用户作为替代零件,就需要510(k)。
如果生产的器械不上市或不进行商业分发,就不需要 510(k)评估或检验器械。这包括临床评估。如果生产的器械用于进行临床试验,则可能受到研究用器械赦免(IDE)法规的管理。
如果分销其他公司国内生产的器械,代理商不需要递交510(k)。代理商可以把“Distributed by ABC Firm”的标签贴在器械上,卖给终端用户而不用递交510(k)。
大多数情况下,如果器械现有的标签或条件没有显著改变,那么再包装者或再标注者就不要求递交510(k)。
如果器械是在1976年5月28日之前合法上市的,就不用递交510(k)文件,除非进行了改进或使用目的上有变化。这些器械被称为“grandfathered”。
如果是外国制造器械的进口商,在下列情况下不需要递交510(k):
510(k)已经由外国厂家递交,并得到上市批准,或
510(k) 已经由进口商代表外国厂商递交了,并得到上市批准。如果一个进口商代表外国厂商递交了510(k),那么所有从相同的国外厂商(510(k)持有人)进口相同器械的其他进口商就不要求递交此器械的510(k)文件。
谁来检查企业是否符合 QSR820?
FDA 下属的 CDRH( 器械与放射健康中心 ) 是专职负责医疗器械企业管理的机构,其根据 FDA 的授权安排检查员到个企业进行工厂检查。对美国境内企业一般每两年检查一次,境外企业不定期检查。所有检查费用由FDA承担,检查只是一个符合性检查,不颁发任何证,不属于认证活动。
我公司专业办理欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂辅导,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、医疗器械单一体系审核MDSAP认证、BSCI验厂辅导、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证
SUNGO依托专业的技术服务团队、优质的战略合作资源,为国内外企业完成FDA申请方案,测试及报告,完成510k申请文件的编写及提交。另外,SUNGO还可协助企业建立QSR 820质量管理体系,*模拟美国FDA工厂审核,*陪同美国FDA工厂审核全过程,提供美国FDA授权代理人服务。SUNGO在美国FDA认证各个环节能均能提供完整服务,并与美国FDA官员保持良好的沟通,为企业排忧解难!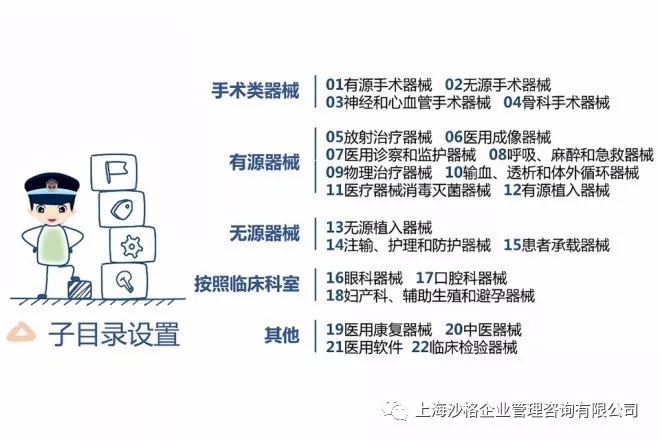
医疗器械美国 FDA 510(k) 认证
为了在美国上市医疗器械,制造商必须经过两个评估过程其中之一:上市前通知书 [510(k)] (如果没有被 510(k) 赦免),或者上市前批准 (PMA) 。大多数在美国进行商业分销的医疗器械都是通过上市前通知书[510(k)]的形式得到批准的。在某些情况下,在 1976 年 5 月 28 日之前合法上市的器械,既不要求递交 510(k) 也不要求递交 PMA 。
我公司专业办理欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂辅导,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、医疗器械单一体系审核MDSAP认证、BSCI验厂辅导、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证
谁来检查企业是否符合 QSR820?
FDA 下属的 CDRH( 器械与放射健康中心 ) 是专职负责医疗器械企业管理的机构,其根据 FDA 的授权安排检查员到个企业进行工厂检查。对美国境内企业一般每两年检查一次,境外企业不定期检查。所有检查费用由FDA承担,检查只是一个符合性检查,不颁发任何证,不属于认证活动。
对Ⅰ类产品,企业向FDA递交相关资料后,FDA只进行公告,并无相关证件发给企业;对Ⅱ、Ⅲ 类器械,企业须递交PMN或PMA,FDA在公告的同时,会给企业以正式的市场准入批准函件(Clearance),即允许企业以自己的名义在美国医疗器械市场上直接销售其产品。至于申请过程中是否到企业进行现场GMP考核,则由FDA根据产品风险等级、管理要求和市场反馈等综合因素决定。而通常情况下,GMP检查是在产品上市之后进行。
综合以上内容可知,绝大部分产品在递交510(K)申请、进行企业注册、产品列名后,即可获得FDA批准上市。
我公司专业办理欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂辅导,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、医疗器械单一体系审核MDSAP认证、BSCI验厂辅导、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证
医疗器械FDA常见问题
医疗器械在申请FDA认证过程中,经常会遇到这样或那样的问题,下面是我们SUNGO工程师总结的一些比较常见的问题:
1、很多企业对FDA的认证类别划分不是很清楚,有些明明是2类的产品,非说是I类,我们告诉她是II类产品,还说我们肯定搞错了,真的有点悲哀。
2、除了类别划分不清楚外,有些企业还对FDA的管制法规不了解,有些人以为做了FDA认证或注册就万事大吉,就可以毫无悬念的清关,对产品质量根本就不在意,一味的只追求利润,这是很可怕的。因为美国海关经常会对中国进口来的产品进行临时抽检,如果你出口的产品质量很差,万一抽检不合格,那就惨了,FDA处罚违规的出口商是很严厉的。
我公司专业办理欧盟,美国,澳大利亚以及中东南美等等国家各类认证:FDA510K认证,欧盟自由销售证书,欧盟授权代表,ISO13485/ISO9001认证,欧盟CE认证(MDR(REGULATION (EU) 2019/745)),FDA注册,FDA验厂辅导,英国授权代表,MHRA注册,美国代理人服务,澳大利亚TGA认证,CE整套技术文件编订、 CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写)、防护服PPE指令Type5/6认证、医疗器械单一体系审核MDSAP认证、BSCI验厂辅导、BRC 认证,澳大利亚TGA注册、口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试,医疗器械产品备案登记表、医疗器械产品注册证、生产备案登记表、生产许可证
http://song520521.cn.b2b168.com
欢迎来到上海沙格企业管理咨询有限公司网站, 具体地址是上海市浦东新区金桥镇世纪大道1500号,联系人是袁阳。
主要经营SUNGO集团专注于MDRCE认证、FDA注册和FDA510K、欧盟自由销售证明、FDA验厂、CE临床评估报告、欧盟授权代表和欧盟注册等,经验丰富,值得信赖,欢迎广大客户来电咨询。。
单位注册资金单位注册资金人民币 500 - 1000 万元。
你有什么需要?我们都可以帮你一一解决!我们公司主要的特色服务是:MDRCE认证,FDA注册和FDA510K,欧盟自由销售证明,FDA验厂,CE临床评估报告,欧盟授权代表和欧盟注册等,“诚信”是我们立足之本,“创新”是我们生存之源,“便捷”是我们努力的方向,用户的满意是我们较大的收益、用户的信赖是我们较大的成果。