 7
7
欧盟授权代表和欧盟注册号码是什么?
对欧盟境外的医疗器械制造商来说,无论产品是哪个类别,都需要*一个欧盟境内的授权代表,作为其在欧盟的一个法律实体。
欧盟授权代表(European Authorized Representative )是指由位于欧洲经济区EEA(包括EU与EFTA)境外的制造商明确*的一个自然人或法人。该自然人或法人可代表EEA境外的制造商履行欧盟相关的指令和法律对该制造商所要求的特定的职责。
欧盟授权代表在产品流通在欧盟市场的过程中起到了至关重要的沟通、协调以及解决问题的作用。
在现如今这个信息发达的社会,很多制造商都知道欧盟授权代表的定义,以及欧盟授权代表主要承担了哪些职责。
那具体细节如何执行,有哪些特殊的要求等问题,可能很多医疗器械制造商并不是十分了解。我们参考了欧盟具体的指南文件,从几个问题中介绍一下法规的具体要求:
1. 哪些技术文档必须要发给欧盟授权代表处进行保存?
授权代表有义务保留国家主管部门掌握的某些信息,例如合格声明和技术文件(AIMDD附件2*6.1节; MDD附件II*6.1节,附件III*7.3节,附件IV*7节,附件V部分) 5.1,附件VI*5.1节,附件VII*2节; IVDD*9(7)和10(3)条)。
授权代表必须能够提供市场监督机构为进行市场监督而可能需要的所有文件和信息(*765/2008 / EC号条例*19条)。
当局根据转换指令或根据*765/2008 / EC号条例的国家立法提出任何信息请求。因此,关于这种请求或“命令”的合法性与否的任何问题都是由国家法院决定的。
该信息可以与授权代表一起存储,授权代表应被授权将信息直接分发给当局。在这种情况下,合同应包括制造商的义务,以保持信息始终更新。
如果制造商选择不向授权代表存储信息,他应向授权代表提供市场监督机构在接收到授权代表转发的请求后可能需要的所有文件和信息,以便进行市场监督。制造商、授权代表应该可以访问所有文档和信息。
在这种情况下,合同必须确保制造商及时向授权代表提供所要求的信息,并且应包括制造商的义务,以便随时向授权代表通报任何变更。授权代表如果后者未向他提供获取必要信息的,则应撤销与制造商的合同。
很多客户不愿意把产品技术文档交给欧代,或者会提供部分的产品技术文档,按照欧盟针对欧盟授权代表的指南文件MEDDEV2.5-10要求,欧代必须要保留至少以下的文件:
i) Declaration of conformity,
ii) Copy of the label, packaging and instructions for use (in all languages requested by the countries where the device is marketed),
iii) Notified Body certification (where relevant),
iv) Post market surveillance process and data, vigilance reports and complaints, processes and data
v) Technical documentation relevant to market surveillance investigation being undertaken by the Member State,
vi) Relevant clinical data / notification,
vii) Details of any distributors / suppliers putting the CE marked devices on the market,
viii) Incident reports and corrective actions taken.
2. 产品出口到欧盟前,欧代是否必须要把制造商的信息和产品的信息向所在国注册?
按照欧盟93/42/EEC MDD的要求*14条的要求,I类的产品在出口到欧盟前必须要由其欧盟授权代表向其所在国进行通报/注册。但是像德国,除了MDD指令外德国也有单独的德国医疗器械法规MPG,MPG要求德国的欧盟授权代表要将所有类别医疗器械的信息在次出口到欧盟前向其主管当局进行通报注册。
所以,选择不同的国家的欧盟授权代表也会造成要求的不同,例如选择英国欧盟授权代表的话,I类产品必须在MHRA进行注册,IIA,IIB,III类产品无法进行注册。选择德国欧盟授权代表的话,所有类别产品都必须在出口到欧盟前向DIMDI注册。
3. 是否可以选择多个欧盟授权代表?
按照欧盟授权代表的指南文件MEDDEV2.5-10要求,一个公司可以有多个授权代表,但是同一个产品有且只能选择一个欧盟授权代表。
很多制造商对这块的要求不是很明确,管理上也不精细,很随意的就*一个欧盟授权代表,却不知这样回头会造成很大的隐患,如果产品将来在欧盟出现了事故,欧盟主管当局将不知道联系谁,会造成事故处理的不及时或严重滞后,也会给主管当局在处理事故时造成一个很不正规的印象。
4.简言之
为了更好地保护欧盟的消费者和环境,欧盟的法律要求,为了实现产品的可追溯性,制造商投放到欧盟市场的加贴了CE标志的产品必须标有制造商的名称和联络地址;如果制造商来自欧洲经济区EEA(包括EU与EFTA)以外的国家,其产品必须同时标有制造商和制造商的欧盟授权代表的名称和联络地址。
欧盟授权代表的职责包括
1/ 作为制造商*的授权代表,负责与欧盟范围内各个国家的医疗器械监管机构联系,处理医疗器械的事故、投诉、不良事件以及召回等工作;
2/ 保留制造商的CE技术文件,当监管机构提出问题时,进行联络制造商、回复和沟通;
3/ 受制造商的委托,在欧盟进行医疗器械产品注册;
4/ 受制造商的委托,申请欧盟颁发的自由销售证
CE认证,普通防护口罩,非医用的。需要做测试+CE认证,目前整个周期包含测试和*大概在7个工作日左右。费用的话,每个机构不一样~
一般建议是做NB机构,什么是NB机构呢?可以简单理解为,被欧盟认可的机构。新手小白可以问自己的发证机构两个问题就可以判断是否靠谱了,(1)是NB机构吗?机构号可以查询?(2)证书到时候网站可查吗?
一、如果是欧洲市场出售个人防护口罩
需要满足欧盟个人防护设备标准要求,企业需选择有PPE法规授权的公告机构实施申请,需审核企业质量管理体系和CE技术文档。审核通过后可获得PPE法规的CE证书。欧盟个人防护口罩的标准是EN149,分为三类 FFP1: 过滤效果>80% ,FFP2: 过滤效果>94% ,FFP3: 过滤效果>97% 。
二、如果要在欧洲市场出售医用口罩
欧洲市场医用口罩对应的欧洲标准是EN14683,按照BFE、呼吸阻抗和防喷溅能力分为三个类别,依据产品是无菌或非无菌状态提供,其认证模式不一样。
TUV莱茵,TUV南德,SGS等CE认证(MDD/MDR法规),全套CE技术文件编订, CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售证书,ISO13485:二016,医疗器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请),FDA美国代理人服务/ FDA QSR820验厂辅导及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系辅导/OTC验厂辅导及整改,英国BRC认证咨询,BSCI验厂辅导;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令辅导)。
2017 年4 月5 日,欧洲议会和理事会正式签发了欧盟关于医疗器械*2017/745 号法规(MDR,EU2017/745),5月5日,欧盟期刊(Official Journal of the EuropeanUnion) 正式发布该法规。2017 年5 月25 日,MDR 正式生效, 替代了原医疗器械指令(MDD,93/42/EEC)和主动植入式医疗器械指令(AIMD,90/385/EEC)。
MDR 由指令升级为法规,提高了对欧盟成员国的约束力,具有直接约束性,*各国转化为本国的法律法规的形式即可落实实施。内容上,MDR 在整合原指令的基础上,大幅提升了有关医疗器械认证的规范和限制,例如关于产品分类规则、器械的可追溯性、临床性能研究的规范、增加上市后的产品安全性和有效性的监管等方面。MDR 共10 章123 条,并附有17 个附录。
一、关于法规过渡期
MDR 过渡期为3 年,共涉及四个时间点(见表1):
欧盟医疗器械新法规MDR主要变化情况介绍
仅具有根据90/385/EEC 和93/42/EEC 指令签发的证书的器械可投放市场的前提是自MDR 适用之日起,其在设计和预期目的上无显著变化并符合新法规有关市场后监察、市场监察、警戒、经济运营商及器械注册的规定。
通过豁免指令的形式上市,且符合新法规的器械可在2020 年5 月26 日之前投放市场。并可在2020 年5 月26 日前*并通知符合新法规的符合性评估机构。公告机构可在2020 年5 月26 日前, 采用合规的符合性评估流程并按照新法规签发证书。
对于特定Ⅲ类器械和Ⅱ b 类器械产品,在已委派必要的医疗器械协调小组(MDCG)、*小组前提下,同样可通过指令豁免在2020 年5 月26 日之前投放市场。
法规关于公告机构的要求(正文*35~50 条) 自2017 年11 月26日起适用,即公告机构在新法规发布后的六个月内即应开始进行相应的申请,符合要求后方可依据新法规开展符合性评估。
同时法规对成员国主管机构的*和MDCG 的成立也设定了期限,要求于2017 年11 月26 日前完成。对于成员国主管机构之间的协调,设定期限为2018 年5 月26 日。
二、关于MDR 涵盖产品范围和分类规则
法规对“医疗器械”的定义结合了90/385/EEC 和93/42/EEC 指令的范围,并有所扩大,纳入了有源植入医疗器械、软件以及植入或侵入人体的非医疗用途产品,如隐形眼镜、美容植入物、去除脂肪组织的器械、发射高强度电磁辐射进行皮肤**等操作的器械、利用磁场大脑神经元活动的器械等。对药械组合产品的描述也更为具体,法规还适用于使用活性或非活性动物、人源组织或细胞的产品制造而成的器械。
医疗器械的分类仍延续了之前的大类,即按照风险等级分为四大类:Ⅰ、Ⅱ a、Ⅱ b、Ⅲ类。但分类规则较之前有所增加,由18 条增加至22 条。具体分类规则条款情况及变化情况见下表2:
欧盟医疗器械新法规MDR主要变化情况介绍
三、关于经济运营商各方义务
法规在*I章*2条定义中提出了“经济运营商”的概念,经济运营商是指制造商、授权代表、进口商、经销商以及任何对系统或手术包类器械进行组合或消毒并投放市场的自然人或法人。即在符合法规规定情况下负责器械生产(包括组合或灭菌)、销售及上市后运营的自然人或法人。
法规首先规定了制造商的义务,涵盖生产、合规、上市后监管的产品全生命周期,但法规同时规定,经销商、进口商或其他自然人或法人在向市场提供以其名字、注册商标命名的医疗器械时应承担制造商相应的义务,也包括变更相应器械预期用途或变更其他影响其符合性的事项的情况。在上市后监管要求中,经济运营商同时负有相应的责任和义务。
法规对各方义务的描述更为明确也更为具体,对于制造商的要求更为细化,因此新法规执行后,各方应首先明确自身职责和义务,规范有序地开展生产和市场活动,应审核确认上游供应商是否符合规定,并确认能够证明自己的下游流程符合规定,应按照对应的警戒系统的要求进行或配合事件上报,配合完成现场安全纠正措施,并依据职责组织培训。
四、其他
法规中规定了对于一次性使用器械的再处理即复用的要求。
MDR
*17 条规定,一次性使用的医疗器械的复用只能在相应国家法律允许的情况下进行,且应符合MDR 的规定。任何对一次性使用器械的再处理即复用的自然人或法人应视为复用器械的制造商,承担制造商义务,包括器械的可追溯性。但目前只有部分欧盟成员国接受器械复用并具备相应的法规规定。
MDR 在很多方面的规定都趋于更加严格的监管模式,更加强调持续监管和*协作的监管方式。如从监管层面自上而下确定了欧盟、各成员国、公告机构、经济运营商各自的义务和责任,同时从法规层面设定了成员国之间、公告机构之间及制造商与监管部门之间沟通和协作的制度及途径,从产品监管角度来讲,从产品生产质量体系建立和实施、符合性评估过程中的通用基本要求、技术文件建立、上市后监管文件建立、临床证据等上市前监管要求,到符合性评估程序要求,以及上市后监管、警戒和市场监管等措施,覆盖产品生命周期的全过程,并规定了信息管理的具体要求,包括UDI 及市场监管的电子系统等。
基于本版法规的医疗器械监管将很大程度上提高欧盟对医疗器械产品的要求,不论是制造商还是公告机构都将面临更严格的管理,基于目前的产品分类规则,更多的产品将需要执行公告机构参与的符合性评估流程,更多的品种纳入了医疗器械监管。
五、关于我国审评审批制度可借鉴的思考
基于对法规的研究,在审评审批及监管过程中认为有几点值得借鉴:
首先是整体监管的理念,产品符合性评估程序中不仅包含技术文件审评与生产质量管理体系审核,还包含对上市后监管计划及相关警戒数据报告的审核,且上市后监管责任明确。在产品上市之前即明确了上市后制造商的责任和义务,并使得上市后监管有相应的依据。
其次是持续监管的理念,关于监管评估,法规规定:公告机构应至少每隔12 月开展一次适当的审核和评估,以确保相关制造商采用批准的质量管理体系和上市后监管计划,公告机构至少应每隔五年随机对制造商进行一次现场突击审核。包括对制造商经营场所的审核,必要时还包括对制造商的供应商和/ 或分包商的审核。
另外,上市后临床跟踪的规定,要求制造商主动收集和评估上市后临床数据,旨在确认器械的安全有效性、识别之前未知的并监控已识别的和禁忌症、识别并分析突发风险、确有收益/ 风险的可接受性以及确定器械可能的操作不当或**标示使用以验证其预期用途是否正确。上市后临床跟踪在产品生命周期中的作用不可忽视。
*三,科学监管的理念体现在法规的细节规定或管理要求中。如医疗器械产品种类繁多,法规对于特殊类别产品,其符合性评估程序中分别规定了特殊要求,例如与药物一同使用的器械的认证程序、利用人类或动物源组织或细胞及其物制造器械时的认证程序等,体现特殊产品的个性化要求;对于高风险产品,欧盟法规规定了*小组的职责中包含临床前咨询的程序;对于变更事项的规定,欧盟法规更接近产品本身,如涉及设计或特性的更改、协调标准更改等,使得变更事项更为明确。
另外,欧盟在符合性评估过程中允许产品发生变化,相比于中国法规审评审批过程中无法变更的要求,这种方式更为灵活;充分利用UDI 及电子数据系统等工具, 从欧盟法规层面规定了电子系统的建立和使用要求,从而增加器械上市的透明度和可追溯性。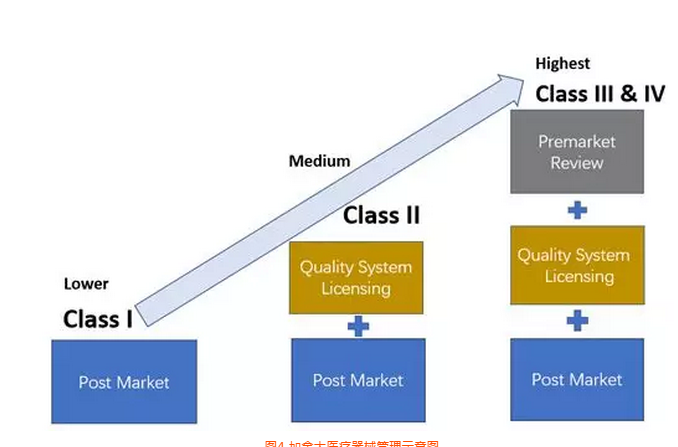
刚结束的2月后两周,我们接到很多工厂关于医用口罩产品办理国内许可证书的申请。随着国内的口罩供应逐步缓解,同时海外的疫情发展加快,口罩产品出口需求已可以清晰预见。为应对近两天广大客户关于口罩出口认证的问询,SUNGO整理相关国家和地区法规要求以及我们可以提供的服务内容。摘要见表1
Part.1
欧洲市场
欧洲市场对于口罩的管理分为两个主要类别,个人防护口罩和医用口罩。个人防护口罩主要是工业用防护,医用口罩主要是医院使用。
医用口罩
医用口罩对应的欧洲标准是EN14683,该标准对于口罩的分类如下图所示,按照BFE、呼吸阻抗和防喷溅能力分为三个类别,具体指标见表2。
表2 欧洲医用外科口罩的分类
按照医疗器械法规2017/745/EU的要求,口罩产品可以按照一类器械进行管理。依据产品是无菌或非无菌状态提供,其认证模式不一样。
1.非无菌方式提供
1)编制技术文件
2)提供测试报告(可以提供熔喷布性能测试报告和无纺布的生物学报告)
3)编制DOC
4)*欧盟授权代表并完成欧洲注册
2.无菌方式提供
1)灭菌验证
2)建立ISO13485体系
3)编制技术文件
4)提供测试报告(口罩本身的生物学、性能、无菌等测试报告)
5)公告机构审核(目前只能按照MDR审核,预计近期没有NB可以审核)
6)获CE证书
7)*欧盟授权代表并完成欧洲注册
从目前整体情况来看,如果之前没有获得公告机构的CE证书,现在临时去申请已经没有可能性,因此目前出口到欧洲的口罩产品应该只有非无菌状态提供一个选项。但是非无菌并不是对生产环境完全不控制,EN14683对于产品的初始污染菌要求不大于30cfu/g。
2防护口罩
防护口罩的欧洲标准是EN149,按照标准将口罩分为FFP1/FFP2和FFP3三个类别,具体的指标见表3
。
表3 欧洲防护口罩分类
防护口罩需要满足欧盟个人防护设备指令(PPE)的要求,防护口罩属于其中复杂设计的产品。出口欧洲需要授权的公告机构进行认证并颁发证书,认证需要的资料包括:
A)产品的型式试验报告;
B)技术文件评审
C)工厂质量体系审查。
Part.2
美国市场
美国法规对医用口罩和工业防护口罩同样是区分管理,其中医用口罩由FDA管控,而防护口罩则由NIOSH管控。大家熟知的N95口罩就来源于NIOSH对口罩分类中的一个类别。
医用口罩
美国对于医用口罩的管理机构是FDA,在FDA系统中对于口罩的分类代码有如下3个。其中一个是外科口罩,一个是口罩,一个是带有/抗病毒介质的外科口罩,见图1。
三个类别的口罩都属于规则878.4040,分类都是II类,都需要申请510K批准。那么我们正常出口美国的口罩必须的路径为:
1)进行产品测试(性能测试、生物学测试)
2)准备510K文件,提交FDA评审
3)FDA发510K批准信
4)完成工厂注册和器械列名
5)产品出口
但是该过程至少需要半年以上时间。那是否有其他可选方法呢?SUNGO咨询师经过分析提供两种其他可选路径:
(1)已经获得NIOSH批准的N95口罩可以直接注册
从图2可以看出,如果你的N95口罩获得了NIOSH的批准,生物学测试、阻燃测试和血液穿透测试都通过了,那么你是可以豁免510K的,可以直接进行工厂注册和器械列名。
(2)获得持有510K的制造商的授权,作为其代工厂使用其510K批准号进行企业注册和器械列名。申请方需要获得授权书,需要签署正式的质量协议,FDA会进行核实和抽查。如果使用未经许可的号码,将会导致产品召回的风险。
2防护口罩
NIOSH将口罩分成N95、N99、N100、R95、R99、R100、P95、P99、P100合计9个类别。从某种意义上来说,N95算是其中防护级别比较低的品类。
NIOSH的口罩防护等级认证程序复杂,包括:
送样品到NIOSH认可的实验室进行预检,通常是美国实验室;
编写技术文件提交NIOSH评审,通常包括:
✰ 产品图纸
✰ 产品说明
✰ 质量体系文件
✰ 测试报告
工厂检查
核发证书
Part.3澳洲市场
澳洲的医用口罩按照I类管理,需要在TGA进行备案之后可以销售。当然在澳洲的备案需要由澳洲当地的SPONSOR来完成,其合规流程为:
1)*SPONSOR(SUNGO 澳洲可以提供服务)
2)完成技术文档
3)提交TGA进行备案
4)获得证书(见图3)
Part.4
加拿大
加拿大医疗器械产品分为4类,其中1类风险,不需要做器械注册(MDL),只需要进行MDEL(制造商注册),见图4。
图4 加拿大医疗器械管理示意图
加拿大的口罩产品属于I类医疗器械进行管控,按照其法规如果是中国制造商,可以选择:
1)申请MDEL证书自行出口
2)找到加拿大持有MDEL证书的进口商交易
申请MDEL需要完成申请表的如下内容,提交后2-4周可以获得证书。
(1)公司名称及联系方式
(2)许可文件、邮寄和帐单地址
(3)分类和活动表
(4)场地地址
(5)制造商信息
(6)证明
(7)签名