 7
7
口罩要做的EN14683检测是什么?
我公司专业办理医疗产品出口欧盟、美国、中东南美等国家的各种认证:
TUV莱茵,TUV南德,***等CE认证(MDD/MDR法规),全套CE技术文件编订, CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售证书,ISO13485:二016,医疗器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请),FDA美国代理人服务/ FDA QSR820验厂辅导及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系辅导/OTC验厂辅导及整改,英国BRC认证咨询,BSCI验厂辅导;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令辅导)。
欧盟标准 EN 14683
This standard is intended to help facilitate the choice of surgical face masks in the European Market by standardizing the information and performance data required for the masks.
本标准旨在利用标准化的信息和口罩的性能数据来帮助欧盟市场方便的选择外科口罩。
There are three test methods used to classify surgical masks:
有三种测试方法用来给外科口罩进行分类:
1. Bacterial Filtration Efficiency in vitro (BFE) (ASTM F2101-07)
体外过滤率(BFE)(ASTM F2101-07)
• Test is used to determine the amount of infective agent that is retained by the surgical facemask, which is directly related to the amount of bacteria released through the mask into the air of the surgical theatre.
• 这个测试是用来确定外科口罩上残留的源,此源直接影响到手术室空气中由口罩中释放出的数目。
• To test, a controlled flow of air containing an aerosol with a controlled concentration of Staphylococcus aureas is driven through a sample of the surgical mask containing all layers. The average size of the aerosol droplets is around 3.0 Micron. The number of bacteria that passes the sample is compared to the number that passes without the mask sample.
• 测试方法:使用一个喷雾装置,用来释放出固定流量的空气流,这个空气流包含着一定浓度的金葡萄球菌,让这股空气流穿过包含所有层的外科口罩。喷雾口的平均尺寸为3微米。通过样品的数目和没有样品时的数目进行比较。
• A higher BFE percentage indicates a better protection level for the patient against infective agents from the OR staff.
• 这个BFE比值越高,说明口罩能更好的保护病人不易因为手术人员而感染。
Classification:
分类
• BFE => 95% TYPE I
• BFE => 98% TYPE II
• A different BFE test called the "Modified Green & Vesley" or BFE in vivo has been used frequently in the past. This test method always provides extremely high values, but does not really differentiate between different quality surgical facemasks. The BFE in vivo test method is therefore not part of the new EU standard.
• 不同的BFE测试可以称为“修改版的Green&Vesley”或者体外BFE,这种方法在过去经常被使用。这种测试方法能提供较高的值,但并不真正的区分出不同质量外科口罩。这种体外BFE测试方法因此没有成为新的欧盟标准的一部分。
2. Breathing Resistance (Delta P)
呼吸阻抗 它是指气体在流经呼吸道及呼吸装置时的耗功加总值。
• Test is used to determine the resistance airflow of the facemask.
• 这种测试来确定口罩的气流阻力。
• To test, a controlled flow of air is driven through a sample of the surgical mask containing all layers. The pressure before and after the sample is measured; the difference in pressure is divided by the surface (in cm2) of the sample.
• 测试方法:使用一股定量的气流通过包含所有层的外科口罩样品。测量通过样品之前和之后的压力,这个不同的压力值再除以口罩的表面积(cm2)。
• A lower breathing resistance indicates a better comfort level for the user. It means the mask feels cooler and easier to breath through, and that the mask will maintain its shape in a better way as there is less pressure on the material. There will be less unfiltered air escaping around the mask.
• 一个较低水平的呼吸阻抗值说明使用者使用起来更舒服。说明口罩戴起来感觉更加凉爽和更*呼吸,因为在材料上面的压力较小,所以口罩更*保持不变形。这样还能减少从口罩边缘呼出的未经过滤的气体。
Classification:
分类
• TYPE I & II (non splash resistant) = < 3.0 mmH2O/cm2
• 类别I&II(非防溅)= < 3.0 mmH2O/cm2
• TYPE IR & IIR (splash resistant) = < 5.0 mmH2O/cm2
• 类别IR&IIR(防溅)= < 5.0 mmH2O/cm2
• The breathing resistance is always measured per square centimeter of material. One way to increase comfort is to have a low breathing resistance value per cm2, the other to enlarge the surface of the facemask and thereby the total area available for ventilation.
• 呼吸阻抗通常是用来测量每平方厘米材料上的值。一个增加舒适性的方法就是降低每平方厘米的呼吸阻抗,另外的一个方法就是通过增大口罩的表面积来增大口罩的可过滤的区域。
3. Splash Resistance (ASTM F1862-07)
防溅阻力 指防止血液\体液等溅撒 物的阻止能力.
• Test is used to determine the resistance penetration of potentially contaminated fluid splashes.
• 这种测试是用来确定对潜在污染流飞溅的穿透阻碍作用。
• To test, a precisely determined quantity of specially prepared artificial blood is sprayed at a controlled pressure against a sample of the mask. Frequently these tests are done at pressures of 80, 120 and 160 mmHg. A visible inspection on the backside of the sample indicates if there is a fluid strike-through (red color) or not. The test is repeated 32 times at each pressure, and if three or less masks show a strike through, the product is considered splash resistant at that pressure.
• 测试方法:精确定量的人造血液在固定的压力下面通过样品口罩进行喷洒。常用的测试压力一般为80,120和160mmHg。可以通过观察样品口罩背面的是否有通过的液体的痕迹(红颜色)来判断。这个测试在每个压力条件下重复32次,3次以下的液体渗出,就可以判断产品在此压力下具有防溅性能。
• A higher splash resistance means the mask will protect the user in a better way against splashes of potentially contaminated fluid during a surgical procedure.
• 一个较高的防溅性能意味着这个口罩可以更好的保护在手术中使用者不受潜在的污染液体飞溅的侵害。
Classification: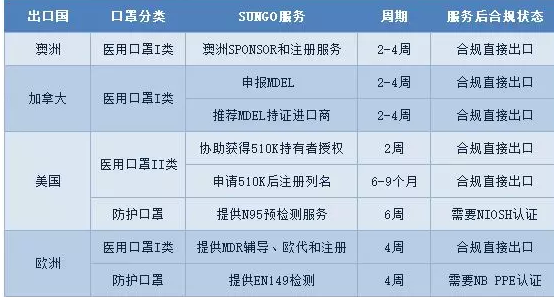
公司从2017年年初开展临床评估业务以来,为国内近两百家医疗器械企业提供了临床评估报告编撰服务,其中包括很多国内**的大型医疗器械企业。*四版欧盟临床评估指南的发布,的确给企业带来了不小的挑战,此文对主要变化进行了梳理。
主要变化之一:临床报告更新的频率
按照新版临床报告指南的要求,对于高风险或者新设备,应每年更新;对于低风险的设备,每2-5年更新。对于如何确定更新的额频率需要有定义。对于任何风险类别的器械,如果从PMS收集到的信息影响到评价或者结论,CER需要进行更新。
主要变化之二:报告编写人和评价人的
按照新版临床报告指南的要求,对于临床报告的编写人提出了要求。包括需要有相关专业的高等教育学位以及至少五年的专业经历,或者十年的专业工作经历,如果学位不够的话。如果不能满足要求,需要对其进行判定和说明。
主要变化之三:评价报告需要有明确的可测量的目标
*四版临床评估指南对于临床评估报告的目的有更明确的描述,需要与器械的安全性、性能以及风险-收益平衡进行更加清晰和详细的描述,在指南的*7部分和附件5中有详细的描述。
主要变化之四:确定技术发展水平
*四版临床评估指南对于设备的技术发展水平和处理方式的建立和文件化,提供了更加详细的描述。这包括确定设备的安全性和性能,以及被宣称的比对器械,行业的基准器械,或者其他的类似器械;需要包括风险和收益的分析。
主要变化之五:数据的科学性和有效性
*四版临床评估指南非常强调数据的科学性和有效性,包括从统计学考虑。这贯穿于整个指南文件规定的阶段,包括影响数据完整性的因素,数据的客观性和权重,文件搜集的方法,数据的评估和权重,数据是否阐述了符合性的分析。
主要变化之六:比对器械
*四版临床评估指南对于评估器械和比对器械的等效有了更加详细的规定,特别强调对于比对器械的数据的可获得性。需要从临床数据、技术参数、生物性能三个方面逐一比对,确保所有比对的内容不存在差异。
主要变化之七:比对器械的数据获得
*四版临床评估指南要求公告机构对于企业是否能够获得比对器械的数据进行挑战,这个被认为是法规的一个转折点,这要求制造商需要有一个被允许接触竞争对手的器械数据的协议。
主要变化之八:什么时候需要临床试验
*四版临床评估指南附件2详细描述了器械的风险以及制造商怎么决定是否具备了充分的临床证据。
主要变化之九:风险-收益
附件7提供了详细的指南,对于器械的安全性和性能表述;
附件7.2 讨论了风险和收益分析,包括对于风险和收益的量的评估,以及总体评价。交付后的数据价值,以及可能会影响统计有效性行的因素等。
主要变化之十:售后监督和售后临床跟踪
*四版指南强调了临床评估、售后监督和售后临床评估的关系。附录12强调了公告机构需要确认PMCF被很好的策划了,以及依据所收到的数据来描述其满足CER。
欧盟个人防护口罩(非医疗器械)
欧盟个人防护口罩的欧洲标准是EN149,按照标准将口罩分为FFP1/FFP2/FFP3三个类别,需要满足欧盟(EU)2016/425个人防护设备指令(PPE)的要求。主流的防护口罩为FFP2/FFP3两类。
认证流程:
1. 产品的型式试验报告
2. 技术文件评审
3. 工厂质量体系审查
4. 颁发CE证书
5. 产品出口
注意:必须选择有PPE发证能力的发证机构申请,发证机构通过评审EN149报告后颁发CE-PPE证书。
NO.2
欧盟医用口罩(医疗器械)
医用口罩的欧洲标准是EN14683,按照标准将医用口罩分为TYPE Ia/TYPE II/TYPE IIR三个类别。Type Ia用于流行病期间的患者和其它人群,Type II和Type IIR用于医护人员。需要满足欧盟(EU)2017/745(新版医疗器械MDR)的要求。口罩在欧盟属于I类器械,但是分为I类非无菌和无菌两种。
1.非无菌口罩(现阶段只有这种可行)
1)编制技术文件
2)提供测试报告(例如熔喷布性能测试报告和无纺布的生物学报告)
3)提供符合性声明
4)*欧盟授权代表完成欧洲注册
时间估计:2-3个月
2.无菌口罩(现阶段新版MDR实施难度很大)
1)灭菌确认
2)ISO13485体系认证
3)编制技术文件
4)提供测试报告(生物学、性能、无菌等测试报告)
5)公告机构审核(目前几乎没有公告机构愿意接单)
6)获得CE证书
7)*欧盟授权代表完成欧洲注册
时间估计:1-2年,因此今年几乎是不可能了!
检测标准
1)生物学评价:ISO10993-1,-5,-10(常规三项)
2)过滤效率:EN 14683:2019附录B
3)呼吸阻抗:EN 14683:2019的附录C
4)防溅阻力:ISO 22609:2004
5)生物负载:EN ISO 11737-1:2018、EN 14683:2019附录D(同一批次检测数量不少于5个)
NO.3
美国FDA注册医用口罩
常见的医用口罩在美国FDA属于II类医疗器械,产品代码为FXX,规则号878.4040。除此之外还有OXZ口罩和OUK带/抗病毒介质的外科口罩。一般来说选择FXX类型的口罩。
510k申请流程:
1)进行产品测试(性能测试、生物学测试)
2)准备510k技术文件,提交FDA审评
3)获得FDA的510k批准信
4)完成工厂注册和器械列名
时间估计:6-10个月
注意:如已从途径获得N95认证并通过生物学、阻燃和血液穿透测试可豁免510k
口罩检测必须满足ASTM的标准,如下:
NO.4
美国NIOSH认证防护口罩
防护口罩需要获得NIOSH(美国国家职业安全卫生研究所)认证。按照过滤效率个人防护口罩可分成N95、N99、N100、R95、R99、R100、P95、P99、P100共9个类别。
按过滤网材质的过滤效率,可将口罩分为三种等级:N ,R ,P
N类的口罩只能过滤非油性颗粒物,比如:粉尘、酸雾、漆雾、微生物等。空气污染中的悬浮微粒,也多是非油性的。
R类的口罩只适合过滤油性颗粒物及非油性颗粒物,但用于油性颗粒物时限制使用时间不得**过8小时。
P类的口罩则既可过滤非油性颗粒物,又可过滤油性颗粒物。油性颗粒物比如:油烟、油雾等。
NIOSH认证系列口罩需符合42 CFR Part 84的要求,测试指标包括呼气阻力测试(Exhalation Resistance Test)、呼气阀泄漏测试(Exhalation Valve Leakage Test)、吸气阻力测试(Inhalation Resistance Test)、过滤效率测试(Sodium Chloride Test)等。
认证的申请需按照NIOSH的指南实施,企业需寄送样品至NIOSH实验室实施测试,同时提交技术性资料(包括质量体系资料)至NIOSH进行文件审核,只有文件审核和产品测试都通过,NIOSH才会核发认证。具体的认证则由NIOSH下属的NPPTL 实验室操作。
时间估计:2-3个月
近年来SUNGO为国内众多制造商提供了FDA验厂的辅导和翻译陪审服务。这其中包括了FDA提**天通知验厂的时间较端紧迫的案例,也包括了为连续两次验厂失败的制造商解除警告信并移除进口禁令的复杂度较高的案例。
PART 1
FDA工厂审查的概况
FDA每年会对**的医疗器械制造商进行抽样审查,作为其进行售后市场监管的主要途径之一。所有的审查都会由美国FDA的工作人员进行,不论这些人是什么族裔,他们都是美国籍,都代表了美国的利益。
近几年,在美国以外的国际市场,中国制造商的被抽样量一直稳居****。目前中国在FDA的注册制造商约为4500家左右,每年抽查的概率在2-3%。通常FDA工厂审查会由1名审查官进行为期4天的现场审查。制造商*支付任何审查费用。
PART 2
FDA工厂审查的直接后果
大部分的中国制造商收到美国FDA的审查通知都会比较重视,基本上都会积极应对,动员内外部的力量和资源来确保审查顺利进行。当然也有部分制造商不了解审查可能会导致的结果,没有给予足够的重视,导致后面很被动的局面。
FDA工厂审查的直接结果会有三种,分别是NAI,VAI和OAI。
代码 全称 中文译意
NAI No Action Indicated *采取整改
VAI Voluntary Action Indicated 自愿采取整改
OAI Official Action Indicated 强制采取整改
NAI表示在FDA工厂审查时,没有开出任何书面形式的不符合项(由于FDA的不合格报告表单的编号为483,FDA也将不符合简称“483”),也可以称为“零483”。
VAI表示在FDA工厂审查时,FDA审查官发现了工厂的管理系统有违背FDA的质量体系法规的内容,进而开具了书面形式的不符合项,也可以开具了“483”。“483”的个数可能是1个,也可能是20个或更多。只要工厂按照FDA的要求积极整改,提供充分的证据,都不会导致更多后果。
OAI表示在FDA工厂审查时,FDA审查官发现了工厂管理系统存在严重违背FDA的质量体系法规的内容,或者是没有能够按照FDA的要求对于VAI进行及时充分的整改,而开具的警告信(Warning Letter)。如果仅仅是开具了警告信而没有上Import Alert,制造商的产品依然可以出口,但是警告信会公布在FDA网站上,会影响美国客户对制造商的信心,必须尽快采取措施解除。
PART 3
FDA工厂审查的后果放大路径
FDA的审查之所以让很多制造商觉得紧张,是因为稍有不慎,其结果的严重性可能会*放大,终让制造商失去整个美国市场。其放大路径如下:
1. VAI没有按照FDA要求进行充分整改,会发展成为OAI;
2. OAI没有按照FDA要求及时响应,会被列入Import Alert;
3. 进入了Import Alert,企业的出口产品入境时会被自动没收(DWPE)。
由于FDA工厂审查导致的Import Alert要移除,通常都需要进行再次的工厂审查。除了再次的工厂审查之外,还有海量的证据需要随同书提交FDA审查。从开始处理到终完成Import Alert移除的过程,效的处理周期需要一年时间。当然伴随着的还有巨额的费用。
SUNGO在2016年帮助某中国制造商(其在2013年和2015年两次验厂失败,背有两封警告信和进口禁令)成功解除了警告信并移除进口禁令。问题能在一年内被我们解决,项目算是很顺利,但是这家制造商丢掉了原有的大部分的美国市场,损失很大。
值得一提的是,很多国内的制造商,碰到产品不能出口时通常会寻求国际律所的帮助,例如本杰明、霍根路伟等。但实践表明,技术法规的符合性问题大部分时候并非是律所可以解决的。
PART 4
避免严重后果的方法
面对可能的严重后果,预防永远是有效和成本的途径。采取预防措施,我们的建议是:
1) 当您的产品进入美国市场之前,尽快建立起QSR820 体系。
2) 寻求第三方的专业机构进行辅导。
3) 寻求第三方的专业机构进行模拟审核。
4) 在收到FDA验厂通知时,尽快联系专业机构提供支持。
特别指出的是:有部分企业终被开具警告信并进入Import Alert是由于FDA现场审查时候的翻译人员对于技术法规和公司的质量管理系统不清楚导致翻译不准确,终导致审查员开具了很多不应该有的不符合。因此,寻找专业的翻译陪审也非常关键。
SUNGO的FDA验厂辅导优势 :
1) 辅导团队具备多年**美资企业的法规工作经验;
2) 具有成功辅导包括新华医疗集团在内的近百家企业通过FDA审核的经验;
3) 具有成功辅导FDA提**天通知的飞行检查的经验; 咨询师具有优秀的语言能力,担任陪审和翻译的任务会使得企业应对更轻松。