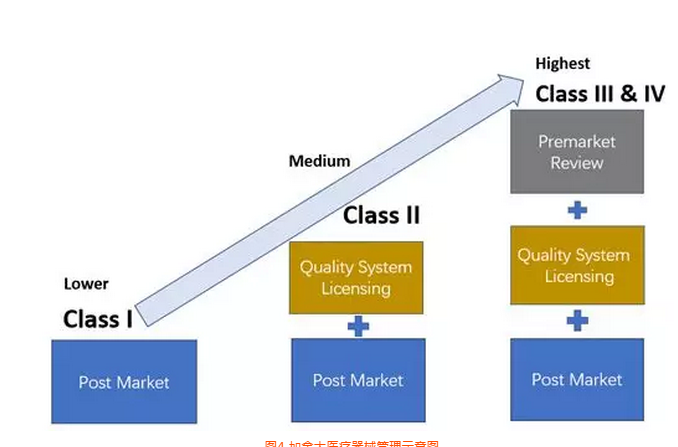
7
7
一、MDR的主要变化
1.扩大了应用范围
2.提出了新的概念和器械的定义
3.细化了医疗器械的分类
4.完善了器械的通用安全和性能要求
5.加强对技术文件的要求
6.加强器械上市后的监管
7.完善临床评价相关要求
8.提出Eudamed数据库的建立和使用
9.提出器械的可追溯性(UDI)
10.对NB提出严格的要求
二、对NB提出的严格要求
对“公告机构”,新版MDR花费大篇幅对其进行职能和要求进行描述;各NB需按照附录VII的要求重新申请MDR的三方审核的授权
三、MDR适用范围扩大
新MDR不仅包含了MDD及AIMDD涵盖的所有产品;还覆盖专门用于器械的清洁、消毒或灭菌的器械,以及Annex XVI列举的无预期医疗目的的产品,如美瞳、面部填充或注射、纹身、皮肤改善和美容等产品。
包含某些药械结合产品,详细请见Article1(8,9)。
包含某些由非活性或处理为非活性的人类来源组织或细胞物制造的特定产品。
包含声称仅具有美容目的或另一种非医疗目的,但在功能和风险特征方面类似于医疗器械的特定产品组
声明纳米材料器械属于MDR范围,且要接受为严格的评估程序。
包含发射离子辐射的器械和医疗用途的软件。
四、MDR提出了新的概念和器械的定义
MDR中增加了很多新的概念,从MDD中的14个概念,增加到现在的71个,如增加了一些临床试验方面和上市后监管方面的概念,如 “recall ,withdraw ,serious incident, clinical consent, clinical benefit(召回、撤回、严重事件、临床同意、临床受益)”.详情请见Article2
五、器械的分类变化
从MDD到MDR,器械仍分为四大类:I类、I*类(Is(一类灭菌)/Im(一类测量)/Ir(一类可重复使用))、IIa类、IIb类、III类,其中一类中可重复使用器械归属为I*类。
MDD中与分类相关是93/42/EEC中的 Annex IX 和相应的指南MEDDEV 2. 4/1 Rev. 9;新的MDR中Article51和Annex VIII 详细阐述了产品的分类信息。主要变化是由MDD的“18条”,改为MDR的“22条”。
器械类型 MDD MDR
NON-INVASIVE DEVICES Rule 1- Rule 4 Rule 1-Rule 4
INVASIVE DEVICES Rule 5-Rule 8 Rule 5-Rule 8
ACTIVE DEVICES Rule 9-Rule 12 Rule 9-Rule 13
SPECIAL RULES Rule 13-Rule 18 Rule 14-Rule 22
Rule1-Rule 4: NON-INVASIVE DEVICES非侵入性器械
Rule3: 增加了用于体外直接从人体或人类胚胎取外使用的人体细胞、组织、气管,然后再植入或注入体内,此类器械为III类。
Rule 5-Rule 8:INVASIVE DEVICES侵入性器械
Rule 8:在原来的基础上添加了:有源植入器械或其相关附件,植入物或心脏修补网状织物,完整或部分关节置换物,直接与脊柱接触的椎间盘置换植入物为III类。
Rule 9-Rule 13:ACTIVE DEVICES有源器械
Rule9:在原来的基础上增加了“针对**目的释放电离辐射的有源器械”以及“用于控制、监测或直接影响有源植入式器械”,这两大类器械均为II b类。
Rule11:新添加,提出用于提供诊断或**目的决策信息和监测生理过程的软件,均为II a类;其他软件类为I类。
Rule 14-Rule 22:SPECIAL RULES特殊规则
Rule14:进一步完善了“自人体血液或血浆的医疗产品”分类的要求。
Rule 18:进一步完善“利用非活性或处理为非活性的人体或动物源组织或细胞或其他物制成的器械”的分类要求。
Rule19:添加对纳米材料器械的分类要求。
Rule20:添加了通过吸入方式,与身体孔口相关的侵入器械的分类。
Rule 21:添加了引入人体可吸收物质到人体的器械。
Rule22: 添加了具有集成或合并诊断功能的有源**器械的分类。
欧盟授权代表(European Authorized Representative,EU Representative,欧代,EC REP,EU REP)简介
参考文件
MEDDEV 2.5/10
GUIDELINE FOR AUTHORISED REPRESENTATIVES
欧盟授权代表(European Authorized Representative )是指由位于欧洲经济区EEA(包括EU与EFTA)境外的制造商明确*的一个自然人或法人。该自然人或法人可代表EEA境外的制造商履行欧盟相关的指令和法律对该制造商所要求的特定的职责。
为了更好地保护欧盟的消费者和环境,欧盟的法律要求,为了实现产品的可追溯性,制造商投放到欧盟市场的加贴了CE标志的产品必须标有制造商的名称和联络地址;如果制造商来自欧洲经济区EEA(包括EU与EFTA)以外的国家,其产品必须同时标有制造商和制造商的欧盟授权代表的名称和联络地址。
2.欧代职责:
法规*I章 *35条
对于欧盟以外的制造商,授权代表在确保此类制造商生产的器械符合性,以及作为其在欧盟建立的联系人方面发挥关键作用。
鉴于这种关键作用,若欧盟以外的制造商未遵守其一般义务,出于执法目的,其授权代表依然应当对有缺陷的器械负法律责任。
本法规规定的授权代表的法律责任并不影响*85/374/EEC号指令的规定,因此授权代表应对进口商和制造商承担连带责任。
应在书面指令中确定授权代表的职责。鉴于授权代表的角色,应明确规定其应满足的要求,包括提供满足资格条件的人员的要求,此类资格条件应与制造商处负责法规符合性的人员的资格条件类似。
法规*II章 *11 条 授权代表
授权代表应执行其和制造商间授权同意的*任务。授权代表应根据要求向主管机构提供授权书副本。
授权书应要求且制造商应协助授权代表至少执行相关器械的以下任务:
(a) 核实已拟定符合性和技术文件的欧盟声明,且在适当时核实制造商已实施适当符合性评估流程。
(b) 保留一份可用的技术文件、欧盟符合性声明副本。如适用,保留一份包括所有修订和补充的相关证书副本,并按照*56 条,在*10(8)条*时期,由主管机构签发;
(c) 遵守*31 条规定的注册义务,并核实该制造商已遵守*27 和29 条规定的注册义务;
(d) 响应主管机构的要求,提供所有必要信息和文档,采用相关成员国确定的欧盟语言,证明器械符合要求;
(e) 向制造商转达,授权代表具有其经营样品注册地成员国主管机构的所有要求,或访问器械,并核实主管机构收到样品或可访问器械;
(f) 配合主管机构采取的任何预防或纠正措施以消除或,如不可行,降低由器械导致的风险;
(g) 立即通知制造商来自医护专业人员、患者和使用者与有关*器械可疑事件的投诉和举报;
(h) 如制造商违反本法规义务,则终止授权书。
在不影响本条*4 段的情况下,当所有成员国的制造商都未确立,且未遵守*10 条规定义务时,授权代表应与制造商一样为缺陷器械承担法律责任,并一样负有共同连带责任。
根据*3 段(h)点所述的理由终止任务的授权代表应立即将任务的终止和原因通知其所在成员国的主管机构,适当时也可通知参与该器械符合性评估的公告机构。
CE认证,即只限于产品不危及人类、动物和货品的安全方面的基本安全要求,而不是一般质量要求,协调指令只规定主要要求,一般指令要求是标准的任务。因此准确的含义是:CE标志是安全合格标志而非质量合格标志。是构成欧洲指令核心的"主要要求"。 [1]
“CE”标志是一种安全认证标志,被视为制造商打开并进入欧洲市场的护照。CE代表欧洲统一(CONFORMITE EUROPEENNE)。
在欧盟市场“CE”标志属强制性认证标志,不论是欧盟内部企业生产的产品,还是其他国家生产的产品,要想在欧盟市场上自由流通,就必须加贴“CE”标志,以表明产品符合欧盟《技术协调与标准化新方法》指令的基本要求。这是欧盟法律对产品提出的一种强制性要求。
词意起源编辑
CE是法语的缩写,英文意思为 “European Conformity 即欧洲共同体,事实上,CE还是欧共体许多国家语种中的"欧共体"这一词组的缩写,原来用英语词组EUROPEAN COMMUNITY 缩写为EC,后因欧共体在法文是COMMUNATE EUROPEIA,意大利文为COMUNITA EUROPEA,葡萄牙文为 COMUNIDADE EUROPEIA,西班牙文为COMUNIDADE EUROPE等,故改EC为CE。当然,也不妨把CE视为CONFORMITY WITH EUROPEAN (DEMAND)(符合欧洲(要求)),构成欧洲指令核心的"主要要求",在欧共体1985年5月7日的(85/C136/01)号《技术协调与标准的新方法的决议》中对需要作为制定和实施指令目的"主要要求"有特定的含义,即只限于产品不危及人类、动物和货品的安全方面的 基本安全要求,而不是一般质量要求,协调指令只规定主要要求,一般指令要求是标准的任务。产品符合相关指令 有关主要要求,CE 标志是安全合格标志而非质量合格标志。20世纪40年代,西欧国家感到,要在美苏两大国之间保证自己的安全,提高国际地位,加快经济发展,必须联合起来,因此力推欧洲一体化进程。欧洲一体化可分五个层次:建立自由贸易区、关税同盟、统一大市场、经济联盟和联盟。
发证机构编辑
(1)企业自主签发的Declaration of conformity / Declaration of compliance《符合性声明书》,此证书属于自我声明书,不应由第三方机构(中介或测试认证机构)签发,因此,可以用欧盟格式的企业《符合性声明书》代替。
(2)Certificate of compliance / Certificate of compliance《符合性证书》,此为第三方机构(中介或测试认证机构)颁发的符合性声明,必须附有测试报告等技术资料TCF,同时,企业也要签署《符合性声明书》。
(3)EC Attestation of conformity 《欧盟标准符合性证明书》,此为欧盟公告机构(Notified Body简写为NB)颁发的证书,按照欧盟法规,只有NB才有资格颁发EC Type的CE声明。
认证程序编辑
确认出口国家
若出口至欧洲经济区EEA包括欧盟EU及欧洲自由贸易协议EFTA的30个成员国中的任何一国,则可能需要CE认证。
确认产品类别及欧盟相关产品指令
若一个产品同时属于一个以上的类别,则必须满足所有类别相对应的产品指令中所列出的要求。注: 某些产品指令中有时会列出一些排除在指令外的产品。
欧盟授权代理
Authorized Representative
为了能确保前述CE标志 (CE Marking ) 认证实施过程中的4项要求得以满足,欧盟法律要求位于30个EEA 盟国境外的制造商必须在欧盟境内*一家欧盟授权代表(欧盟授权代理)(Authorized Representative),以确保产品投放到欧洲市场后,在流通过程及使用期间产品“安全”的一贯性;技术文件(Technical Files)必须存放于欧盟境内供监督机构随时检查;对被市场监督机构发现的不合CE要求的产品、或者使用过程中出现事故但是已加贴CE标签的产品,必须采取补救措施。(比如从货架上暂时拿掉,或从市场中*地撤除);已加贴CE标签之产品型号在投放到欧洲市场后,若遇到欧盟有关的法律更改或变化,其后续生产的同型号产品也必须相应地加以更改或修正,以便符合欧盟新的法律要求。