 7
7
口罩要做的EN14683检测是什么?
我公司专业办理医疗产品出口欧盟、美国、中东南美等国家的各种认证:
TUV莱茵,TUV南德,***等CE认证(MDD/MDR法规),全套CE技术文件编订, CE*四版临床评价(MEDDEV 2.7.1 Rev 4)编写,欧盟授权代表,欧盟自由销售证书,ISO13485:二016,医疗器械单一审核程序(MDSAP)审核、美国FDA注册(含FDA510K申请),FDA美国代理人服务/ FDA QSR820验厂辅导及整改,FDA警告信应对&RED LIST REMOVAL/QSR820体系辅导/OTC验厂辅导及整改,英国BRC认证咨询,BSCI验厂辅导;口罩NELNSON(尼尔森)检测:(EN 14683检测、BFE检测,VFE检测、PFE检测)、手术衣EN13795测试、防护服type5/6 (PPE认证咨询(89/686/EC个人防护指令辅导)。
欧盟标准 EN 14683
This standard is intended to help facilitate the choice of surgical face masks in the European Market by standardizing the information and performance data required for the masks.
本标准旨在利用标准化的信息和口罩的性能数据来帮助欧盟市场方便的选择外科口罩。
There are three test methods used to classify surgical masks:
有三种测试方法用来给外科口罩进行分类:
1. Bacterial Filtration Efficiency in vitro (BFE) (ASTM F2101-07)
体外过滤率(BFE)(ASTM F2101-07)
• Test is used to determine the amount of infective agent that is retained by the surgical facemask, which is directly related to the amount of bacteria released through the mask into the air of the surgical theatre.
• 这个测试是用来确定外科口罩上残留的源,此源直接影响到手术室空气中由口罩中释放出的数目。
• To test, a controlled flow of air containing an aerosol with a controlled concentration of Staphylococcus aureas is driven through a sample of the surgical mask containing all layers. The average size of the aerosol droplets is around 3.0 Micron. The number of bacteria that passes the sample is compared to the number that passes without the mask sample.
• 测试方法:使用一个喷雾装置,用来释放出固定流量的空气流,这个空气流包含着一定浓度的金葡萄球菌,让这股空气流穿过包含所有层的外科口罩。喷雾口的平均尺寸为3微米。通过样品的数目和没有样品时的数目进行比较。
• A higher BFE percentage indicates a better protection level for the patient against infective agents from the OR staff.
• 这个BFE比值越高,说明口罩能更好的保护病人不易因为手术人员而感染。
Classification:
分类
• BFE => 95% TYPE I
• BFE => 98% TYPE II
• A different BFE test called the "Modified Green & Vesley" or BFE in vivo has been used frequently in the past. This test method always provides extremely high values, but does not really differentiate between different quality surgical facemasks. The BFE in vivo test method is therefore not part of the new EU standard.
• 不同的BFE测试可以称为“修改版的Green&Vesley”或者体外BFE,这种方法在过去经常被使用。这种测试方法能提供较高的值,但并不真正的区分出不同质量外科口罩。这种体外BFE测试方法因此没有成为新的欧盟标准的一部分。
2. Breathing Resistance (Delta P)
呼吸阻抗 它是指气体在流经呼吸道及呼吸装置时的耗功加总值。
• Test is used to determine the resistance airflow of the facemask.
• 这种测试来确定口罩的气流阻力。
• To test, a controlled flow of air is driven through a sample of the surgical mask containing all layers. The pressure before and after the sample is measured; the difference in pressure is divided by the surface (in cm2) of the sample.
• 测试方法:使用一股定量的气流通过包含所有层的外科口罩样品。测量通过样品之前和之后的压力,这个不同的压力值再除以口罩的表面积(cm2)。
• A lower breathing resistance indicates a better comfort level for the user. It means the mask feels cooler and easier to breath through, and that the mask will maintain its shape in a better way as there is less pressure on the material. There will be less unfiltered air escaping around the mask.
• 一个较低水平的呼吸阻抗值说明使用者使用起来更舒服。说明口罩戴起来感觉更加凉爽和更*呼吸,因为在材料上面的压力较小,所以口罩更*保持不变形。这样还能减少从口罩边缘呼出的未经过滤的气体。
Classification:
分类
• TYPE I & II (non splash resistant) = < 3.0 mmH2O/cm2
• 类别I&II(非防溅)= < 3.0 mmH2O/cm2
• TYPE IR & IIR (splash resistant) = < 5.0 mmH2O/cm2
• 类别IR&IIR(防溅)= < 5.0 mmH2O/cm2
• The breathing resistance is always measured per square centimeter of material. One way to increase comfort is to have a low breathing resistance value per cm2, the other to enlarge the surface of the facemask and thereby the total area available for ventilation.
• 呼吸阻抗通常是用来测量每平方厘米材料上的值。一个增加舒适性的方法就是降低每平方厘米的呼吸阻抗,另外的一个方法就是通过增大口罩的表面积来增大口罩的可过滤的区域。
3. Splash Resistance (ASTM F1862-07)
防溅阻力 指防止血液\体液等溅撒 物的阻止能力.
• Test is used to determine the resistance penetration of potentially contaminated fluid splashes.
• 这种测试是用来确定对潜在污染流飞溅的穿透阻碍作用。
• To test, a precisely determined quantity of specially prepared artificial blood is sprayed at a controlled pressure against a sample of the mask. Frequently these tests are done at pressures of 80, 120 and 160 mmHg. A visible inspection on the backside of the sample indicates if there is a fluid strike-through (red color) or not. The test is repeated 32 times at each pressure, and if three or less masks show a strike through, the product is considered splash resistant at that pressure.
• 测试方法:精确定量的人造血液在固定的压力下面通过样品口罩进行喷洒。常用的测试压力一般为80,120和160mmHg。可以通过观察样品口罩背面的是否有通过的液体的痕迹(红颜色)来判断。这个测试在每个压力条件下重复32次,3次以下的液体渗出,就可以判断产品在此压力下具有防溅性能。
• A higher splash resistance means the mask will protect the user in a better way against splashes of potentially contaminated fluid during a surgical procedure.
• 一个较高的防溅性能意味着这个口罩可以更好的保护在手术中使用者不受潜在的污染液体飞溅的侵害。
Classification: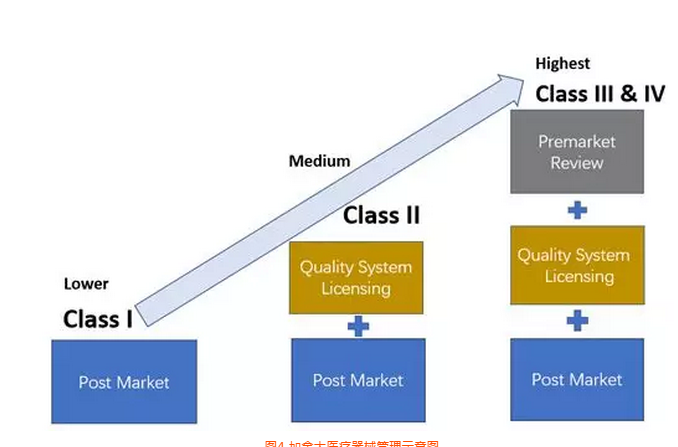
刚结束的2月后两周,我们接到很多工厂关于医用口罩产品办理国内许可证书的申请。随着国内的口罩供应逐步缓解,同时海外的疫情发展加快,口罩产品出口需求已可以清晰预见。为应对近两天广大客户关于口罩出口认证的问询,SUNGO整理相关国家和地区法规要求以及我们可以提供的服务内容。摘要见表1
Part.1
欧洲市场
欧洲市场对于口罩的管理分为两个主要类别,个人防护口罩和医用口罩。个人防护口罩主要是工业用防护,医用口罩主要是医院使用。
医用口罩
医用口罩对应的欧洲标准是EN14683,该标准对于口罩的分类如下图所示,按照BFE、呼吸阻抗和防喷溅能力分为三个类别,具体指标见表2。
表2 欧洲医用外科口罩的分类
按照医疗器械法规2017/745/EU的要求,口罩产品可以按照一类器械进行管理。依据产品是无菌或非无菌状态提供,其认证模式不一样。
1.非无菌方式提供
1)编制技术文件
2)提供测试报告(可以提供熔喷布性能测试报告和无纺布的生物学报告)
3)编制DOC
4)*欧盟授权代表并完成欧洲注册
2.无菌方式提供
1)灭菌验证
2)建立ISO13485体系
3)编制技术文件
4)提供测试报告(口罩本身的生物学、性能、无菌等测试报告)
5)公告机构审核(目前只能按照MDR审核,预计近期没有NB可以审核)
6)获CE证书
7)*欧盟授权代表并完成欧洲注册
从目前整体情况来看,如果之前没有获得公告机构的CE证书,现在临时去申请已经没有可能性,因此目前出口到欧洲的口罩产品应该只有非无菌状态提供一个选项。但是非无菌并不是对生产环境完全不控制,EN14683对于产品的初始污染菌要求不大于30cfu/g。
2防护口罩
防护口罩的欧洲标准是EN149,按照标准将口罩分为FFP1/FFP2和FFP3三个类别,具体的指标见表3
。
表3 欧洲防护口罩分类
防护口罩需要满足欧盟个人防护设备指令(PPE)的要求,防护口罩属于其中复杂设计的产品。出口欧洲需要授权的公告机构进行认证并颁发证书,认证需要的资料包括:
A)产品的型式试验报告;
B)技术文件评审
C)工厂质量体系审查。
Part.2
美国市场
美国法规对医用口罩和工业防护口罩同样是区分管理,其中医用口罩由FDA管控,而防护口罩则由NIOSH管控。大家熟知的N95口罩就来源于NIOSH对口罩分类中的一个类别。
医用口罩
美国对于医用口罩的管理机构是FDA,在FDA系统中对于口罩的分类代码有如下3个。其中一个是外科口罩,一个是口罩,一个是带有/抗病毒介质的外科口罩,见图1。
三个类别的口罩都属于规则878.4040,分类都是II类,都需要申请510K批准。那么我们正常出口美国的口罩必须的路径为:
1)进行产品测试(性能测试、生物学测试)
2)准备510K文件,提交FDA评审
3)FDA发510K批准信
4)完成工厂注册和器械列名
5)产品出口
但是该过程至少需要半年以上时间。那是否有其他可选方法呢?SUNGO咨询师经过分析提供两种其他可选路径:
(1)已经获得NIOSH批准的N95口罩可以直接注册
从图2可以看出,如果你的N95口罩获得了NIOSH的批准,生物学测试、阻燃测试和血液穿透测试都通过了,那么你是可以豁免510K的,可以直接进行工厂注册和器械列名。
(2)获得持有510K的制造商的授权,作为其代工厂使用其510K批准号进行企业注册和器械列名。申请方需要获得授权书,需要签署正式的质量协议,FDA会进行核实和抽查。如果使用未经许可的号码,将会导致产品召回的风险。
2防护口罩
NIOSH将口罩分成N95、N99、N100、R95、R99、R100、P95、P99、P100合计9个类别。从某种意义上来说,N95算是其中防护级别比较低的品类。
NIOSH的口罩防护等级认证程序复杂,包括:
送样品到NIOSH认可的实验室进行预检,通常是美国实验室;
编写技术文件提交NIOSH评审,通常包括:
✰ 产品图纸
✰ 产品说明
✰ 质量体系文件
✰ 测试报告
工厂检查
核发证书
Part.3澳洲市场
澳洲的医用口罩按照I类管理,需要在TGA进行备案之后可以销售。当然在澳洲的备案需要由澳洲当地的SPONSOR来完成,其合规流程为:
1)*SPONSOR(SUNGO 澳洲可以提供服务)
2)完成技术文档
3)提交TGA进行备案
4)获得证书(见图3)
Part.4
加拿大
加拿大医疗器械产品分为4类,其中1类风险,不需要做器械注册(MDL),只需要进行MDEL(制造商注册),见图4。
图4 加拿大医疗器械管理示意图
加拿大的口罩产品属于I类医疗器械进行管控,按照其法规如果是中国制造商,可以选择:
1)申请MDEL证书自行出口
2)找到加拿大持有MDEL证书的进口商交易
申请MDEL需要完成申请表的如下内容,提交后2-4周可以获得证书。
(1)公司名称及联系方式
(2)许可文件、邮寄和帐单地址
(3)分类和活动表
(4)场地地址
(5)制造商信息
(6)证明
(7)签名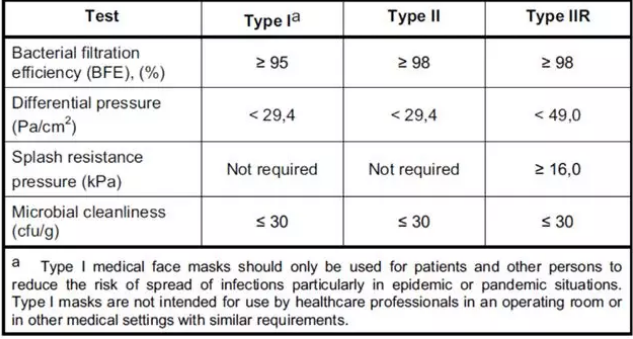
EN14683检测,常用于防护服、手术衣、手套等产品的检测。它主要含三部分的检测:过滤率、呼吸阻抗、防溅阻力。其中过滤率就是常说的BFE检测,BFE/PFE/VFE是不同级别的过滤效果检测,PFE是比BFE级别更高的过滤效果检测,VFE是病毒过滤效果检测。
EN14683有EN14683:2005和EN14683:2014两种版本,其中2005版是旧版本,2014位新版本,现在做检测都是需要按照EN14683:2014标准来执行。
欧盟个人防护口罩(非医疗器械)
欧盟个人防护口罩的欧洲标准是EN149,按照标准将口罩分为FFP1/FFP2/FFP3三个类别,需要满足欧盟(EU)2016/425个人防护设备指令(PPE)的要求。主流的防护口罩为FFP2/FFP3两类。
认证流程:
1. 产品的型式试验报告
2. 技术文件评审
3. 工厂质量体系审查
4. 颁发CE证书
5. 产品出口
注意:必须选择有PPE发证能力的发证机构申请,发证机构通过评审EN149报告后颁发CE-PPE证书。
NO.2
欧盟医用口罩(医疗器械)
医用口罩的欧洲标准是EN14683,按照标准将医用口罩分为TYPE Ia/TYPE II/TYPE IIR三个类别。Type Ia用于流行病期间的患者和其它人群,Type II和Type IIR用于医护人员。需要满足欧盟(EU)2017/745(新版医疗器械MDR)的要求。口罩在欧盟属于I类器械,但是分为I类非无菌和无菌两种。
1.非无菌口罩(现阶段只有这种可行)
1)编制技术文件
2)提供测试报告(例如熔喷布性能测试报告和无纺布的生物学报告)
3)提供符合性声明
4)*欧盟授权代表完成欧洲注册
时间估计:2-3个月
2.无菌口罩(现阶段新版MDR实施难度很大)
1)灭菌确认
2)ISO13485体系认证
3)编制技术文件
4)提供测试报告(生物学、性能、无菌等测试报告)
5)公告机构审核(目前几乎没有公告机构愿意接单)
6)获得CE证书
7)*欧盟授权代表完成欧洲注册
时间估计:1-2年,因此今年几乎是不可能了!
检测标准
1)生物学评价:ISO10993-1,-5,-10(常规三项)
2)过滤效率:EN 14683:2019附录B
3)呼吸阻抗:EN 14683:2019的附录C
4)防溅阻力:ISO 22609:2004
5)生物负载:EN ISO 11737-1:2018、EN 14683:2019附录D(同一批次检测数量不少于5个)
NO.3
美国FDA注册医用口罩
常见的医用口罩在美国FDA属于II类医疗器械,产品代码为FXX,规则号878.4040。除此之外还有OXZ口罩和OUK带/抗病毒介质的外科口罩。一般来说选择FXX类型的口罩。
510k申请流程:
1)进行产品测试(性能测试、生物学测试)
2)准备510k技术文件,提交FDA审评
3)获得FDA的510k批准信
4)完成工厂注册和器械列名
时间估计:6-10个月
注意:如已从途径获得N95认证并通过生物学、阻燃和血液穿透测试可豁免510k
口罩检测必须满足ASTM的标准,如下:
NO.4
美国NIOSH认证防护口罩
防护口罩需要获得NIOSH(美国国家职业安全卫生研究所)认证。按照过滤效率个人防护口罩可分成N95、N99、N100、R95、R99、R100、P95、P99、P100共9个类别。
按过滤网材质的过滤效率,可将口罩分为三种等级:N ,R ,P
N类的口罩只能过滤非油性颗粒物,比如:粉尘、酸雾、漆雾、微生物等。空气污染中的悬浮微粒,也多是非油性的。
R类的口罩只适合过滤油性颗粒物及非油性颗粒物,但用于油性颗粒物时限制使用时间不得**过8小时。
P类的口罩则既可过滤非油性颗粒物,又可过滤油性颗粒物。油性颗粒物比如:油烟、油雾等。
NIOSH认证系列口罩需符合42 CFR Part 84的要求,测试指标包括呼气阻力测试(Exhalation Resistance Test)、呼气阀泄漏测试(Exhalation Valve Leakage Test)、吸气阻力测试(Inhalation Resistance Test)、过滤效率测试(Sodium Chloride Test)等。
认证的申请需按照NIOSH的指南实施,企业需寄送样品至NIOSH实验室实施测试,同时提交技术性资料(包括质量体系资料)至NIOSH进行文件审核,只有文件审核和产品测试都通过,NIOSH才会核发认证。具体的认证则由NIOSH下属的NPPTL 实验室操作。
时间估计:2-3个月